Trabajo realizado por Luz María Agulló Chazarra,
Patricia Torreblanca García, Tamara Agulló Clement y Sonia Alarcón Ferrer.
Artículo
original:
1) Introducción
El tracto gastrointestinal distal
funciona como un biorreactor anaerobio, integrado por unos pocos filos
microbianos con una alta diversidad de especies y que median importantes
funciones fisiológicas del huésped así como las transformaciones químicas de componentes
no digeribles en la dieta. Esta relación simbiótica entre la microbiota
intestinal y el hospedador es crucial para mantener un buen estado de salud y
varios organismos han desarrollado estrategias para mantener la homeostasis.
Los probióticos están definidos como
microrganismos vivos que cuando se administran en cantidades adecuadas
confieren un beneficio a la salud del huésped.
En los últimos años un grupo de
investigación ha estado trabajando con cepas de bifidobaterias que son capaces
de producir exopolisacáridos (EPS, son polisacáridos excretados al exterior celular), que juegan un papel muy importante en el
efecto probiótico de algunas cepas productoras. Los EPS sintetizados por
Bifidobacterias son capaces de modificar la adhesión de los probióticos y
entero-patógenos a mucosas de los humanos. También pueden ejercer un papel
productor para la cepa que produce bajo condiciones adversas y se puede
utilizar como sustratos fermentables por la microbiota intestinal humana.
Se ha demostrado que los EPS
producidos por dos cepas de animales fueron capaces de modificar las
poblaciones microbianas intestinales y que son útiles para promover cambios en
la producción de ácidos grasos de cadena corta cuando se ensaya en un pH
controlado, simulando las condiciones de la parte distal del intestino.
También hay que tener presentes los
posibles riesgos que puede conllevar la ingesta de cepas probióticas, ya que
pueden producir proteínas que favorezcan la activación de carcinógenos. Así
mismo hay que tener en cuenta las posibles resistencias a antibióticos, lo cual
es necesario evitar.
2) HIPÓTESIS
La hipótesis que se plantean los
investigadores de este artículo es la siguiente: El uso de bifidobacterias productoras de exopolisacáridos podría ser
adecuado para modular la microbiota intestinal, y por lo tanto ejercerían un
beneficio para la salud.
Y, para comprobar esta hipótesis, se
marcan los siguientes objetivos:
Ø Determinar si
es segura la ingesta oral de las cepas B. animalis subsp. lactis IPLA R1 y B.
longum subsp. longum IPLA E44, por medio de varios experimentos in vivo e in
vitro.
Ø Comprobar la
supervivencia de las bifidobacterias que se ingieren vía oral durante el
almacenamiento del producto y durante el tránsito gastrointestinal (GIT).
Ø Evaluar la
capacidad de estas cepas para modular la microbiota intestinal en un modelo
animal in vivo.
3) EXPERIMENTOS Y RESULTADOS
Se utilizaron cuatro grupos de
ratas:
Ø El grupo
control, con el cual se pretende conocer la microbiota natural de las ratas,
antes de comenzar los experimentos. Por esta razón, este grupo sólo aparece en
uno de los experimentos.
Ø El grupo
placebo, fue alimentado con leche desnatada.
Ø El grupo B1
(alimentados con leche desnatada que contenía B. animalis lactis IPLA R1).
Ø El
grupo B2 (alimentados con leche desnatada que contenía B. longum longum IPLA
E44).
1.- DETERMINAR
LA SUPERVIVENCIA DE LAS CEPAS UTILIZADAS DURANTE EL ALMACENAMIENTO EN FRÍO Y EN
LAS CONDICIONES DEL TRÁNSITO GASTROINTESTINAL:
Se
testó la viabilidad de las cepas de bacterias en leche desnatada a 4ºC durante
4 días (puesto que eran las condiciones de almacenamiento durante la
experimentación). Los resultados fueron que la cepa R1 no perdía viabilidad,
pero que la cepa E44 perdía viabilidad el 4º día de almacenamiento (pero la
pérdida era mínima, por lo que no la tuvieron en cuenta).
También, se
midió
la supervivencia de las bifidobacterias en condiciones que simulan el tracto
gastrointestinal in vitro (Figura 1). En ambas
cepas se apreció un descenso en el recuento en el GJ (jugo gástrico) a pH3. En R1
no se aprecian diferencias entre las diferentes condiciones (gráfica de abajo). En cambio,
en E44 se aprecian variaciones (gráfica de arriba): en el GJ a pH2 la disminución es
mucho más drástica (lo que muestra que E44 tiene una menor tolerancia a la
acidez que R1). Al mezclar la cepa E44 con leche desnatada, observaron una
mayor supervivencia en el GJ a pH2; lo que indica que la leche desnatada supone
una protección para la cepa E44 frente a las condiciones del GIT (ya que
aumenta el pH del GJ de 2 a 4).
 |
| Figura 1 |
2.-
DETERMINACIÓN CUANTITATIVA DE BIFIDOBACTERIUM EN HECES Y CIEGO:
Se tomaron muestras fecales de los 3
grupos de ratas, los días 0, 4, 11, 18 y 24 (figura 2-a); y
observaron que la evolución de las bifidobacterias en estas muestras fue muy
similar en los 3 grupos; después de un incremento inicial en el día 4 (que
estaba probablemente relacionado con los cambios en la dieta causada por la
ingestión de leche) los recuentos vuelven a sus niveles iniciales en el
siguiente punto de muestreo. No hay diferencias estadísticas entre los tres
grupos de ratas a los 4, 11 y 18 días de alimentación, mientras que, los
recuentos de Bifidobacterium fueron significativamente mayores después de 24
días en las heces de las ratas de los grupos B1 y B2 que en las heces de las
ratas del grupo placebo.
En
cuanto a los resultados obtenidos en el análisis del contenido del ciego (figura 2-b), los recuentos de B. animalis respecto al grupo
placebo no mostraron ningún cambio significativo al final del tratamiento con
respecto a los valores iniciales (Día 0, en el grupo control), mientras que los
recuentos de B. longum se redujeron significativamente. También observaron que
los niveles totales de bifidobacterias en el ciego de las ratas de los grupos
B1 y B2, después de 24 días de la administración de probióticos, fueron
relativamente más alta que en el de las ratas del grupo placebo.
Con
este experimento, pudieron concluir que el tratamiento con las cepas R1 y E44
promueve niveles ligeramente superiores de Bifidobacterias en el ciego y las
heces de las ratas.
 |
| Figura 2 |
3.- DETERMINACIÓN
CUALITATIVA DE MICROORGANISMOS EN HECES Y CIEGO:
Determinaron las huellas genéticas
de la microbiota del ciego de 4 ratas de cada grupo (cada banda representa un
tipo de microorganismo distinto), y vieron que no se podía establecer un patrón
relacionado con la administración oral de las cepas de bifidobacterias, ya que
cada rata presentaba una huella genética específica (figura 3-a). Es decir, había
variabilidad inter- e intra-grupos.
Sin embargo, sí que observaron
que había una mayor diversidad de microorganismos en las ratas del grupo B1 que
en las ratas de los otros 2 grupos (figura 3-b). Lo cual
nos indica que la ingesta de la cepa R1 no sólo provoca un aumento de la
cantidad de microorganismos, sino que también aumenta su variabilidad.
 |
| Figura 3 |
4.- EVALUACIÓN
DE LA SEGURIDAD DE LAS CEPAS UTILIZADAS:
Además, los recuentos totales de
anaerobios no difieren significativamente entre ellos para cualquier tejido
analizado, lo que indica que la administración oral de estos microorganismos no
promueve la translocación bacteriana. Las imágenes de la figura 4 muestran los
resultados de las pruebas histopatológicas, en las que se aprecia que no hay
cambios significativos entre los grupos.
 |
| Figura 4 |
Además, se determinó la
concentración mínima inhibitoria (CMI) de ocho antibióticos (gentamicina,
kanamicina, la estreptomicina, la neomicina, tetraciclina, eritromicina,
clindamicina y cloranfenicol) y los resultados obtenidos fueron los esperados
para las bifidobacterias. También se determinó la presencia de genes de
resistencia a tetraciclina, que codifican proteínas ribosómicas de protección.
Se descubrió que la cepa E44 no presentaba resistencia a tetraciclina, pero sí
que lo hacía la cepa R1.
5.- DETERMINACIÓN
DEL CONTENIDO EN AGCC EN HECES Y CIEGO:
La actividad metabólica de la microbiota intestinal se
determinó midiendo la concentración de AGCC en las heces y en el contenido de las
muestras del ciego (tabla 1). Los AGCC son ácidos grasos de cadena corta que son
el producto de la fermentación de la fibra alimentaria soluble por la
microbiota intestinal. Son un importante substrato energético de las células de
la mucosa gastrointestinal y para las células del colon. Los principales AGCC
son el acetato, el butirato y el propionato.
La concentración de AGCC total
detectado en las heces se incrementó durante el tratamiento, en los tres grupos
de ratas, con respecto a los niveles iniciales, aunque no se encontró una
variación importante en las proporciones de AGCC (70% acetato, 13% propionato y
17% butirato). En cuanto a la comparación entre los tres grupos de ratas, la
concentración del total AGCC fue significativamente más alta en los animales
alimentados con bifidobacterias que en el grupo placebo.
El perfil AGCC obtenido en las muestras
del contenido del ciego fue notablemente diferente al de las heces. En
contraposición a la encontrada en las heces, las comparaciones de los tres
grupos de las ratas mostraron que las concentraciones de AGCC totales fueron
significativamente menor en ratas alimentadas con las cepas de bifidobacterias
que en el grupo placebo. Las proporciones también cambiaron (aunque el
propionato se mantuvo como el componente menos abundante): 44% acetato, 18%
propionato y 37% butirato.
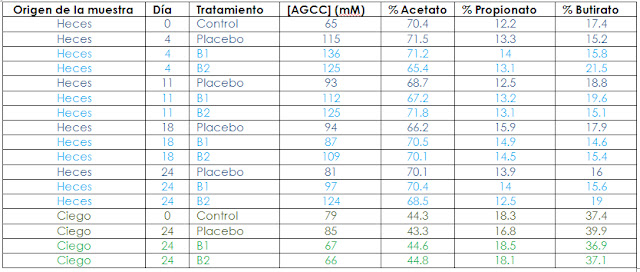 |
| Tabla 1 |
4) DISCUSIÓN
Tal y como se ha visto, las bajas
temperaturas disminuyen la viabilidad de la cepa E44, pero no demasiado, por lo
que no es un impedimento. Las cepas utilizadas tienen una mayor supervivencia
en el tránsito intestinal, aunque la cepa R1 es más resistente a las
condiciones ácidas que la cepa E44 (esta sensibilidad a la acidez se soluciona
administrando la cepa con leche).
La salud de las ratas que ingirieron
las cepas no se vio afectada. Además, no se apreció un traslado de las
bacterias a otros órganos, ya que los recuentos microbianos realizados dieron
el resultado esperado o un poco menor. Además, se apreció que el nivel de B.
animalis en el ciego de las ratas se mantuvo durante el tratamiento, mientras
que el de B. longum decreció, lo que sugiere que la ingesta de leche desnatada
por parte de las ratas favoreció a la población de B. animalis y perjudicó la
permanencia en el tracto de B. longum. De igual forma, la ingesta de
probióticos, prebióticos y simbióticos promueve el aumento en la población de
bifidobacterias en el tracto digestivo de las ratas.
En general, los valores de
resistencia a los antibióticos están dentro de lo esperado para las
bifidobacterias. Aunque se determinó que la cepa R1 es resistente a la
tetraciclina.
Se encontró, en las ratas
pertenecientes a los grupos alimentados con bifidobacterias, una mayor
producción de metabolitos necesarios para mantener unas condiciones adecuadas
en el colon respecto al grupo alimentado con placebo, lo que indica que las
bifidobacterias podrían mejorar su producción. Además, se encontró una
actividad de las cepas utilizadas que alivia los síntomas de la intolerancia a
la lactosa.
La
conclusión que se extrae de este artículo es que los datos experimentales
corroboran la seguridad de las cepas utilizadas en los experimentos y sugieren
que su ingesta podría ser beneficioso para la salud (aunque no hay evidencias
tan claras como para afirmarlo).
Buenas
ResponderEliminarComentarios generales.
Lo que he dicho a otros compañeros. Hay que poner más enlaces internos. Dos enlaces (probióticos y polisacáridos) son muy poco.
Los nombres de las especies van en cursiva.
El tipo de letra usada es muy pequeña y cansada de leer.
Saludos
También hemos puesto un enlace interno en los AGCC...pero intentaremos poner más! :)
ResponderEliminarLos nombres de las especies ya está en cursiva...cuando ponemos sólo cepa E44 o R1, también tenemos que ponerlo en cursiva?
Un saludo.
¿este tamaño de letra está bien?
ResponderEliminarBuenas
ResponderEliminarBastante mejor. No hace falta poner el nombre de las cepas (ej: R1) en cursiva, pero tampoco hace falta que lo cambiéis si ya lo tenéis hecho.
Saludos