Efecto de la temperatura de fermentación en la producción de Validamicina A por Streptomyces hygroscopicus 5008.
Artículo: “Effect of fermentation temperature on validamycin A production by Streptomyces hygroscopicus 5008”
Publicado en la revista: Journal of Biotechnology número 142 del año 2009 (páginas 271- 274).
Autores: Yueqiao Liao, Zhen-Hua Wei, Linquan Bai, Zixin Deng, Jian- Jiang Zhong.
1. INTRODUCCIÓN
En el este de Asia, existe una
enfermedad en el cultivo de arroz llamado “tizón de la vaina” producido por un
hongo. La validamicina A (VAL-A), producida por Streptomyces hygroscopicus es un importante agroantibiótico
antifúngico. En este trabajo, el efecto de la temperatura de fermentación en la
biosíntesis de VAL-A fue investigada entre 28˚C-42˚C, se concluyó que un rango
interesante de temperaturas para esta producción se encuentra entre 35˚C-37˚C.
Los tres operones, valABC, valKLMN y valG, para los ocho genes necesarios
para la producción de validamicina A, fueron activados cuando la temperatura
alcanzaba el umbral. La actividad de la glucosa-6-fosfato deshidrogenasa (G6PDH)
de la ruta de las pentosas fosfato y ValG de la biosíntesis de Val-A fueron
también mejoradas a una alta temperatura de cultivo.
La
enfermedad tizón de la vaina de arroz
presenta la
sintomatología hacia finales del ciclo del cultivo. Se produce el
marchitamiento y secado de hojas quedando adheridas al tallo. Cuando el cultivo
ya se encuentra senescente, se hace visible el signo del patógeno, representado
por hileras de puntos negros sobre el tallo, que son los cuerpos de
fructificación del hongo.
Rhizoctonia solani, el hongo causante de la enfermedad, puede
sobrevivir en el suelo durante muchos años en forma de esclerocios. Los
esclerocios de Rhizoctonia tienen
gruesas capas externas que permiten la supervivencia y funcionan como la
estructura de hibernación del patógeno. En algunos casos raros el patógeno
también puede tomar la forma de micelio que reside en el suelo. El hongo
es atraído a la planta por estímulos químicos liberados por la planta en
crecimiento y/o el residuo de descomposición de la planta.
El proceso de penetración en un
huésped se puede lograr de diferentes maneras. La entrada puede ocurrir a
través de la penetración directa en la cutícula de la planta/epidermis o por
medio de aberturas naturales en la planta. Las hifas entrarán en contacto
con la planta y se unirán por medio del crecimiento, penetrando en la célula de
la planta permitiendo al patógeno obtener los nutrientes. El patógeno también
puede liberar enzimas que descomponen las paredes celulares de la planta, y
continúa para colonizar y crecer dentro del tejido muerto. Esta ruptura de
las paredes celulares y la colonización del patógeno en el huésped es lo que
forma el esclerocio. Un nuevo inóculo se produce en o dentro del tejido
huésped, y un nuevo ciclo se repite cuando se dispone de nuevas plantas.
El ciclo de la enfermedad
comienza durante el invierno. El esclerocio/micelio
se encuentra en los restos en descomposición de plantas, en el suelo o en
plantas huéspedes. Las hifas jóvenes y
basidios en fructificación emergen y
producen micelio y basidiosporas. La producción de basidiosporas en
germinación penetran en el estoma mientras que el micelio se sitúa sobre la
superficie de la planta y secreta las enzimas necesarias en la planta con el
fin de iniciar la invasión de la planta huésped. Después de invadir con
éxito al huésped, se forma necrosis y esclerocios en y alrededor del tejido
infectado que entonces conduce a los diversos síntomas asociados con la
enfermedad, tales como la pudrición del suelo y del tallo… y el proceso
comienza de nuevo.
Validacin es un efectivo
fungicida-bactericida de origen natural, cuyo ingrediente activo es la validamicina
A, producida por Streptomyces hygroscopicus
5008. Inhibe la trehalasa, una enzima
presente en la mayoría de los seres vivos, pero que es inhibida con mayor
efectividad en hongos. Esta inhibición bloquea la reacción que oxida la
trehalosa en dos glucosas. Esto afecta a
la digestión y al transporte de glucosa a las puntas de las hifas, deteniendo
su crecimiento, por tanto el micelio no puede afectar a la planta. Por un lado,
al no producir glucosa se acumula la trehalosa, provocando el hinchamiento de
las células por un efecto higroscópico (capacidad de algunas sustancias de
absorber o ceder humedad al medio ambiente). Por otro lado, al no producirse
glucosa, no se puede producir una sustancia que forma parte de la membrana
(fosfatioinositol), con lo que ésta queda afectada y detiene el crecimiento de
las puntas de las hifas.
2. MATERIALES
Y MÉTODOS
Muestreo y análisis
de fermentación
Las esporas
de S. hygroscopicus 5008 fueron
almacenadas, activadas y cultivadas para luego ser recogidas en seis
duplicados, uno para cada condición de temperatura.
Para
determinar la concentración de proteína intracelular, se centrifugó el micelio,
se lavó y luego se distribuyó a dos tubos Eppendorf, añadiendo lisozima a uno
de los tubos para la lisis de las células. El método estándar de Bradford se
utilizó para determinar la proteína liberada por el micelio, utilizando el colorante azul de
Coomasie G-250 se puede observar que todas aquellas proteínas existentes en la
muestra se tiñen de color azul. Para poder utilizar este método se requiere
realizar una curva de calibración o curva estándar, con soluciones de proteínas
de concentración conocida, a las cuales se les mide la absorbancia en un
espectrofotómetro con una longitud de onda de 595 nm para luego finalmente
poder cuantificarlas. Los
residuos de azúcar se determinaron por el método colorimétrico fenol-sulfúrico,
que gracias a la reacción que produce azúcares simples, fenol y ácido sulfúrico se obtiene
como resultado un color amarillo, naranja. La intensidad
del color es proporcional a la cantidad de carbohidratos presente por lo que se
puede cuantificar los azúcares midiendo la absorbancia. Y finalmente la cantidad de VAL-A producida se midió
por HPLC; con
esta técnica se consigue separar los componentes de una mezcla ya que se basa
en los diferentes tipos de interacciones químicas entre las sustancias a
analizar y la columna cromatográfica.
RNA y análisis de RT-PCR cuantitativa
Los niveles de
transcripción de los genes valABC,
valKLMN y valG fueron determinados por RT-PCR cuantitativa que corresponde
a una variante
de la reacción en cadena de la polimerasa (PCR) utilizada para amplificar y simultáneamente cuantificar
de forma absoluta el producto de la amplificación de ADN. Para ello emplea,
del mismo modo que la PCR convencional, un molde de ADN, al menos un par de cebadores específicos, dNTPs,
un tampón de reacción adecuado, y una ADN polimerasa termoestable; a dicha
mezcla se le adiciona una sustancia marcada con un fluoróforo que, en un termociclador que albergue sensores para medir fluorescencia tras excitar el fluoróforo
a la longitud de onda apropiada, permita medir la tasa de generación de uno o más
productos específicos.
Se utiliza para ello
los Eppendorf Mastercycler Realplex con One Step PrimeScript-RT-PCR Kit. Las
reacciones de control fueron fijadas mediante la adición de RNA sin
transcripción inversa en lugar de cDNA. Después de pre-desnaturalizar a 95°C
durante 5 min, la amplificación se va a producir en dos pasos: 15 s 95°C para
desnaturalizar y 30 s a 60°C para el alineamiento y la elongación y todo este
proceso durante 40 ciclos.
Determinación de actividades enzimáticas
de ValG
La
actividad ValG se analizó de la
siguiente manera: La mezcla de reacción (100 µl) con 25 mM Tris–HCl (pH 7,6),
10 mM MgCl2, 20 mM NH4Cl, UDP-glucosa de 15 mM, 10 mM
validoxylamine A y 2µl de la solución de enzima fue incubada durante 3 h a 30°C,
35°C, 37°C y 42°C, respectivamente, en consonancia con su temperatura de
fermentación. Posteriormente, se añadieron 100 µl de cloroformo para detener la
reacción y la proteína fue retirada. La actividad enzimática se determinó
midiendo la cantidad de VAL-A transformada a partir de validoxylamine por HPLC.
La concentración de la proteína de la solución de enzima se determinó por el
método estándar de Bradford.
3. RESULTADOS
Y DISCUSIÓN
Como es bien sabido, la
síntesis de las proteínas está directamente relacionada con la regulación y
expresión de los genes responsables de su producción y la actividad enzimática
de las reacciones que la llevan a cabo.
Por ello, el experimento se
realizó a tres niveles (cinética de la síntesis proteica, expresión génica y
actividad enzimática) relacionados con la producción de validamicina A.
Velocidad de producción
Además de estudiar el efecto
de la temperatura sobre la velocidad de acumulación de la validamicina A,
también observaron que la temperatura afectaba a otros factores, como la
producción de proteínas intracelulares o el pH.
Proteínas intracelulares
Observaron que en la etapa
inicial (hasta 16 horas), la velocidad de acumulación de proteínas
intracelulares era mayor a altas temperaturas (370C a 420C).
Sin embargo, en la etapa intermedia (hasta 48 horas), la velocidad de síntesis
era mayor a temperaturas inferiores
(entre 280C y 350C). Finalmente, en la etapa tardía
(hasta 120 horas), la producción a altas temperaturas disminuía
considerablemente.
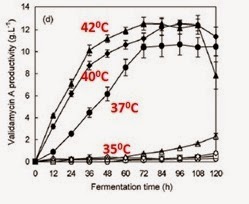
Los resultados que obtuvieron se muestran en la siguiente gráfica:
Al igual que en las demás
proteínas, en la etapa inicial se observó un aumento de la velocidad de
producción a temperaturas altas, sin embargo, este aumento era visible también
en la etapa intermedia. En la etapa tardía, la velocidad disminuía a altas
temperaturas.
Es destacable la diferencia en
las velocidades a las temperaturas de 350C y 370C, lo que
conllevó a definir que la temperatura umbral para incrementar considerablemente
la producción era la de 370C.
Variación del pH
Una temperatura alta durante
la etapa inicial también causa efectos sobre el pH, aumentándolo.
Expresión génica
Para estudiar la expresión de
los genes relacionados con la síntesis de Val-A (valABC, valKLMN y valG) se disgregaron las células de Streptomyces hygroscopicus y se purificó
su ARN con el método del Trizol y eliminando el ADN con la DNasa I. A partir de
este ARN se llevó a cabo una RT-PCR cuantitativa a tiempo real para determinar
el grado de expresión de los genes nombrados.
Se observó un aumento en el
grado de expresión de estos genes al elevar la temperatura de 350C a
370C en las etapas inicial e intermedia, coincidiendo con el aumento
en la producción de validamicina A.
Además la elevada expresión de
valABC y valKLMN en la etapa inicial a 420C
concuerda con una mayor producción del agente antifúngico.
Actividad enzimática
Hay que tener en cuenta que la
temperatura tiene un papel importante no sólo a nivel transcripcional, sino también a nivel
post-transcripcional. Por ello, se estudió la actividad de dos enzimas: la
G6PDH, por su importante función en la ruta de las pentosas fosfato, y la valG,
por participar en la última etapa de síntesis de la validamicina A.
En cuanto a la G6PDH, en la
ruta de las pentosas fosfato produce un precursor para la biosíntesis del
antibiótico, la sedoheptulosa 7-fosfato (S7P). Una elevada temperatura en la
etapa inicial aumenta la actividad de la G6PDH y, sin embargo, en la etapa
siguiente produce una disminución de la misma. En la etapa tardía apenas se
detecta actividad.
Por otro lado, un incremento
en la temperatura aumenta la actividad de valG en la etapa inicial, pero hay
que tener en cuenta que, en la etapa intermedia el aumento sigue, excepto cuando la temperatura
alcanza los 420C.
4. CONCLUSIÓN
El incremento de temperatura
aumenta la actividad de los genes implicados en la síntesis de Val-A, la
actividad de G6PDH (y la ruta PP) y de valG. Todo ello conlleva a una mayor
producción de validamicina A.
En conclusión, conociendo la
ruta de biosíntesis de la validamicina A (o de cualquier otro compuesto) y los
factores que la afectan, se pueden modular para incrementar la producción.
Componentes del grupo: Beatriz García Alonso, Adela Bernabeu Zornoza, Carla Navarro Quiles, Magdalena Nikolaeva Koleva y María Poveda Deltell.
Componentes del grupo: Beatriz García Alonso, Adela Bernabeu Zornoza, Carla Navarro Quiles, Magdalena Nikolaeva Koleva y María Poveda Deltell.



Tenéis fallos bastante importantes.
ResponderEliminarNo aparece la referencia original (ni un enlace a la misma).
Effect of fermentation temperature on validamycin A production by Streptomyces hygroscopicus 5008.
Liao Y, Wei ZH, Bai L, Deng Z, Zhong JJ.
J Biotechnol. 2009, 142:271-4
No aparecen los nombres de los componentes del grupo (vuestros nombres)
No hay enlaces internos que permitan ampliar la información que se da en el texto.
El tono del resumen no es precisamente "divulgativo", sino más bien para "especialistas".
Un saludo